LE DOPAGE GENETIQUE
Le dopage génétique, un détournement de la thérapie génique
La thérapie génique a pour but de guérir les patients de certaines maladies par modification ou remplacement d'un gène défaillant. Cette thérapie une fois au point, pourrait entre autre soigner les patients atteints de la maladie de Parkinson ou encore la dystrophie musculaire
Plutôt que de s'injecter des doses d'EPO certains sportifs préfèrent passer par le dopage génétique. Des gènes responsables de la production d'EPO par les cellules sont injectés dans le corps du sportif. Ces gènes sont lus par les cellules qui se mettent à fabriquer de l'EPO. Cependant cette pratique est mal maitrisée de nos jours et présente de gros risques importants pour les sportifs adeptes de cette pratique.
On retrouve deux types de dopage génétique: le dopage in vivo et le dopage ex vivo.
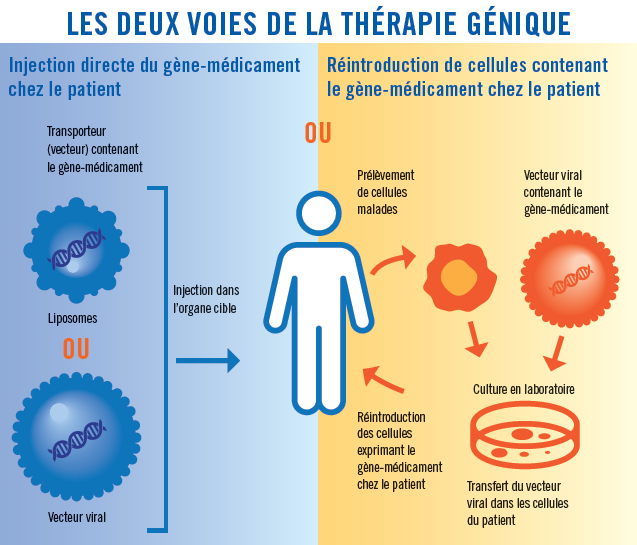
Le dopage in vivo consiste à injecter dans le corps du sportif des liposomes ou des vecteurs viraux contenants les fragments d'ADN recherchés. Les liposomes et/ou les vecteurs viraux parviennent jusqu'aux cellules cibles et se fixent dessus en déposant les fragments d'ADN dans le noyau des cellules qui contient l'information génétique. Etant donné que l'ADN est universel, les cellules lisent les gènes de ces fragments et fabriquent alors de nouvelles substances comme l'EPO par exemple. Ces fragments d'ADN parviennent jusqu'au noyau des cellules, ou se trouve l'information génétique.
Le dopage ex vivo consiste aux prélèvements de cellules du sportif. Ensuite, des vecteurs viraux contenant les gènes à transférer sont introduits dans ces cellules. Après une mise en culture, les cellules sont ensuite réinjectées dans le corps du sportif qui produira donc plus d'EPO qu'en temps normal.
Bien que la thérapie génique, une fois détournée puisse devenir efficace pour les sportif, les scientifiques ne maitrisent pas encore cette thérapie qui peut être dangereuse. De plus, les scientifiques ne connaissent pas les effets de cette thérapie sur le long therme; nous n'avons pas assez de recul sur cette nouvelle forme de dopage. Enfin, les agences de lutte contre le dopage font d'énormes progrès dans la détection du dopage génétique. Les sportifs trichant en utilisant le dopage génétique seront aussi peu à l'abri des sanctions que ceux utilisant des moyens plus "traditionnels".
L'AMA (American Médical Association) a pour but de créer un monde du sport sans dopage. Pour cela elle a investi beaucoup de moyens dans le développement des moyens de détection du dopage génétique. Elle fait d'énormes progrès et permettra peut être de décourager certains sportifs voulant utiliser le dopage génétique en les préservant des nombreux risques encourus par cette forme de dopage.
Afin d'appuyer nos propos, nous avons retranscrit une partie des recherches effectuées par la confédération suisse. Les documents ci-dessus sont le fruit de nombreuses recherches et sont très évocantes. Ces recherches sont sérieuses étant faites par des professionnels de ce milieu.
Si vous souhaitez plus de renseignement à ce sujet : www.rts.ch/decouverte/sante-et-medecine/corps-humain/sexualite
IL PUISE SA FORCE DANS SES GENES
A l'âge de quatre ans, Michael était capable de tenir à bout de bras deux haltères de trois kilos chacun. Son secret ? Une mutation génétique qui bloque la production de myostatine, l'hormone régulant la croissance musculaire
A la naissance de Michael en l'an 2000, les médecins ont été surpris de constater que le bébé avait des muscles comme ils n'en avaient jamais vu chez un nourrisson. Ils ont d'abord cru qu'il était malade. Mais les analyses du neuropédiatre Markus Schülke ont montré que l'enfant était en parfaite santé. Comme sa mère et d'autres membres de sa famille, il était plutôt corpulent et musclé. Une constitution qui s'explique par une mutation génétique : son organisme ne produit en effet pas de myostatine, l'hormone régulatrice de la croissance musculaire. « C'est la myostatine qui indique quand cette croissance doit s'arrêter », explique Markus Schülke. « Lorsque le corps n'en produit pas, les muscles continuent à croître plus longtemps que la normale. » A quatre ans, Michael avait donc deux fois plus de force que ses camarades du même âge. Jusqu'à présent, ce dérèglement ne semble pas causer de problème particulier à l'enfant. Après la découverte de ce cas, les médecins se sont pris à rêver à de nouvelles thérapies pour les sujets souffrant de dégénérescence musculaire. Allait-on pouvoir stopper artificiellement, ou en tout cas freiner, la production de myostatine pour venir en aide aux patients ? Aujourd'hui, le soufflé est un peu retombé. Les études les plus récentes semblent montrer que si les muscles prennent du volume en l'absence de myostatine, le gain en force est beaucoup moins important. L'équation « muscles deux fois plus gros = deux fois plus de force » serait donc fausse.
THERAPIE GENIQUE
Bien que les thérapies géniques n'en soient qu'à leurs débuts, nous sommes optimistes quant aux chances de pouvoir soigner de nombreuses maladies dans un proche avenir grâce à elles. Les gènes sont constitués d'ADN, le vecteur du patrimoine génétique, que l'on retrouve dans toutes les cellules de l'organisme. Les gènes régulent la formation des protéines qui permettent d'assurer des fonctions vitales comme la production d'hormones, la formation sanguine et la croissance musculaire. Si un gène est défectueux ou absent, l'organisme ne peut plus produire la protéine correspondante et le sujet tombe malade. Les milieux médicaux espèrent pouvoir soigner des maladies génétiques - cancers, troubles cardio-vasculaires, maladies héréditaires rares du système immunitaire ou atrophies musculaires - en remplaçant les gènes malades ou défectueux par des gènes sains. Mais la partie s'annonce difficile car il s'agit d'injecter des gènes à l'endroit exact où ils rempliront au mieux leur fonction dans l'organisme. Une solution serait d'utiliser des virus affaiblis. Les virus prolifèrent en insérant leur ADN dans les cellules de leur victime. Mais les techniques génétiques actuelles permettent de modifier ces virus pour qu'ils insèrent des gènes sains au patient. Mais trouver les virus appropriés est difficile. De plus, il faut s'assurer qu'une fois injectés au bon endroit, les gènes « guérisseurs » remplissent leur fonction correctement, en réagissant uniquement au bon signal émis par l'organisme. Des gènes mal placés ou mal pilotés auraient en effet des conséquences fatales. Depuis 1990, plus de 800 essais cliniques de thérapies géniques ont été entrepris sur plus de 5000 patients, avec des résultats parfois impressionnants, notamment sur des enfants souffrant de déficiences immunitaires et de différents types de cancers. Mais les médecins espèrent pouvoir soigner d'autres maladies dans un futur assez proche.
DEROULEMENT D'UNE THERAPIE GENIQUE
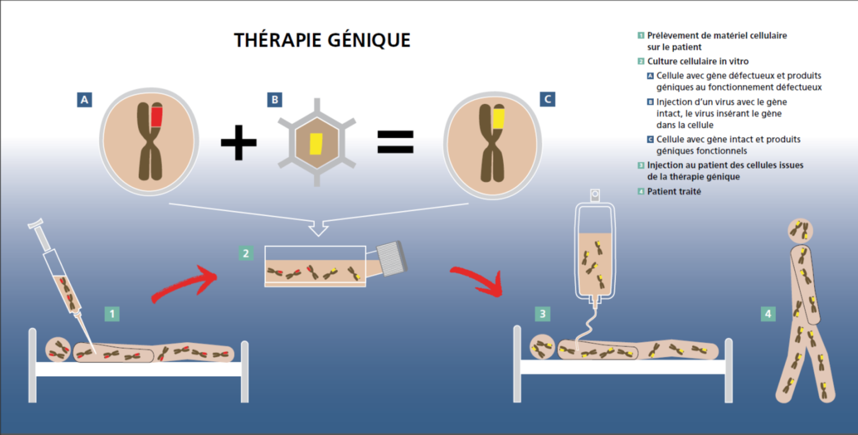
Des virus porteurs de gènes thérapeutiques peuvent être directement injectés dans l'organisme du patient, une méthode peu sûre. Celle consistant à mettre le gène en contact avec les cellules cibles à l'extérieur du corps semble plus prometteuse ; on parle alors de technique in vitro.
Il faut prélever des cellules dans l'organisme et les restituer ultérieurement. Ces cellules doivent être résistantes afin que le gène puisse rester actif longtemps dans le corps. On peut par exemple utiliser des globules blancs (cellules T) ou des cellules de la moelle osseuse, qui forment les globules rouges et blancs. Mais on peut aussi considérer d'autres comme les cellules souches prélevées dans les muscles (appelées cellules satellite). Cependant, même avec des méthodes très efficaces pour introduire des gènes normaux dans les cellules défectueuses, il n'y a aucune garantie que le gène fonctionnera correctement.
Cette approche est appelée « thérapie génique somatique » dans la mesure où les cellules traitées ne sont pas des cellules germinales (sperme et ovules). Les transformations génétiques sont ainsi limitées à l'individu et ne sont pas transmises à sa descendance. La thérapie génique avec des cellules germinales est contestée du point de vue éthique et interdite dans de nombreux pays.
RISQUES ET EFFETS SECONDAIRES
Les effets secondaires graves des thérapies géniques sont assez rares sous des conditions cliniques strictement contrôlées et avec du matériel génétique sain. Mais qu'en serait-il si l'on injectait des gènes illégalement ? Les tests cliniques montrent que les thérapies géniques sont assez sûres, mais pas sans risque.
L'exemple de Jesse Gelsinger, un Américain soufrant d'un dysfonctionnement du foie, le montre: en 1999, ce garçon a participé à une étude clinique où on lui a injecté des virus modifiés dans le foie. Son système immunitaire se révolta : Jesse fut saisi de douleurs et de fièvres, son sang s'est épaissi, ses organes ont cessé de fonctionner et il est mort au bout de quatre jours. On connaît d'autres cas de complications graves provoquées par des thérapies géniques, chez les animaux et les humains. Certains ont entraîné la mort rapide du sujet, d'autres ont provoqué des cancers, des leucémies et des maladies auto-immunes. De tels cas restent rares si les thérapies sont réalisées sous contrôle clinique. Mais que se passerait-il si la technique était détournée pour le dopage ? Il est impossible de prévoir les conséquences à long terme. On sait que quand un athlète dopé ne consomme plus d'anabolisants, les effets sur la croissance des muscles cessent. Mais il est impossible de contrôler ou d'éliminer des facteurs de croissance une fois qu'ils sont injectés. Ils pourraient par exemple faire grossir des cellules tumorales. Concernant l'EPO, on peut certes arrêter une cure mais un athlète ayant reçu des gènes externes aurait toujours des valeurs sanguines élevées, avec les risques connus d'infarctus et d'attaque cérébrale.
DOPAGE GENETIQUE, LE FUTUR
Article tiré d'une enquête de la confédération suisse :
Michi Graf souffre d'une maladie incurable appelée myopathie de Duchenne, qui provoque une atrophie lente et progressive de tous ses muscles. Aujourd'hui, ce garçon peut encore s'asseoir sur sa chaise roulante mais un jour, il ne pourra même plus respirer et mourra probablement avant d'avoir fêté ses 25 ans.
La myopathie de Duchenne, comme d'autres maladies dégénératives du même genre, a des origines génétiques. Partout, des chercheurs tentent de développer des thérapies géniques permettant de les soigner. Dans son laboratoire, Nadia Rosenthal élève des souris, elles aussi atteintes de dégénérescence musculaire. Et elle parvient à les guérir en leur administrant un gène qui produit un facteur de croissance musculaire appelé mIGF-1 et qui compense la fonte des muscles provoquée par la myopathie de Duchenne.
L'objectif est désormais de pouvoir transférer à l'être humain les résultats observés en laboratoire sur des souris. Pour les patients comme Michi Graf, cette recherche est une source d'espoir.